Статьи. Предметно
Флуоресцентная микроскопия полного внутреннего отражения. TIRF – микроскопия.
Микроскопия с многофотонным возбуждением
Микроскопия с двухфотонным возбуждением (также называемая нелинейной, многофотонной или двухфотонной лазерной сканирующей микроскопией) является альтернативой конфокальной и деконволюционной микроскопии, которая имеет определенные преимущества при получении трехмерных изображений. Метод двухфотонного возбуждения особенно превосходит другие при наблюдении неповрежденных тканей, таких как срезы головного мозга, зародыши, целые органы и, даже, целые животные. Эффективная чувствительность флуоресцентной микроскопии, особенно при наблюдении толстых образцов, обычно ограничена внефокусными засветками. Это ограничение в значительной мере преодолевается в конфокальной микроскопии использованием точечной диафрагмы для отсечения внефокусной флуоресценции и получения тонких (меньше 1 микрометра) неразмытых х оптических срезов. В качестве альтернативы, в деконволюционной микроскопии используется традиционный микроскоп для численной реконструкции изображения с помощью функции рассеяния точки оптической системы.
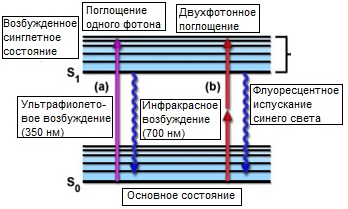
Рис. 1. Диаграмма двухфотонного поглощения Яблонского
В этой статье описываются основные физические принципы многофотонного возбуждения и обсуждаются преимущества и недостатки его использования в лазерной сканирующей микроскопии. Чтобы показать эффективность этого метода и его физические ограничения рассмотрение ведется с практической точки зрения. В конце обсуждаются некоторые эксперименты, проведение которых стало возможным лишь благодаря двухфотонной микроскопии.
Перед проведением эксперимента по оптическому «сечению» необходимо с должным вниманием отнестись к выбору методики, чтобы получить ответы на поставленные вопросы. При наблюдении с помощью флуоресцентной микроскопии относительно толстых образцов, двухфотонное возбуждение часто является наиболее подходящим решением, хотя в определенных экспериментах методы трехмерной флуоресцентной микроскопии будут являться дополнительным преимуществом при любом способе наблюдения.
В конфокальной микроскопии применяется точечная диафрагма для отсечения внефокусной фоновой флуоресценции от канала приемника. Таким образом, эта методика позволяет производить трехмерные сечения более толстых тканей. Тем не менее, падающий свет возбуждает флуоресценцию, порождающую фотообесцвечивание и фототоксичность в образце, даже если сигнал принимается только из фокальной плоскости. Большие дозы облучения могут вызвать значительное фотообесцвечивание и фототоксичность, особенно в живых образцах. Более того, глубина проникновения в конфокальной микроскопии ограничена поглощением потока возбуждающего излучения на пути луча, а также рассеянием возбуждающих и испускаемых фотонов в образце.
Деконволюционная методика часто приводит к лучшим результатам при наблюдении образцов с относительно низким внефокусным фоном или с низким уровнем любых сигналов. Поскольку в деконволюционных методах для получения изображений применяются традиционные широкопольные микроскопы, интенсивность света возбуждения обычно поддерживается на низком уровне. Следовательно, деконволюция обычно эффективно используется для визуализации монослоев живых клеток. Необходимо осознавать, что так называемые деконволюционные методы являются просто нелинейными информационными фильтрами, которые не производят количественных данных. Только действительно ограниченная итерационная деконволюция генерирует количественные данные, которые могут использоваться в дальнейшем анализе. Тем не менее, деконволюция, произведенная в широкопольной флуоресцентной микроскопии, дает ограниченную глубину проникновения в толстый образец из-за возрастающей внефокусной засветки и рассеяния света. К тому же из-за сложного вычислительного процесса, деконволюционные снимки не могут обеспечить немедленной обратной связи во время эксперимента.
С помощью двухфотонного возбуждения, о чем говорится ниже, можно получать оптические срезы в трех измерениях, без приводящего к фотообесцвечиванию и фототоксичности поглощения в областях выше и ниже фокальной плоскости. Следовательно, этот метод позволяет увеличить, по сравнению с конфокальной микроскопией, глубину проникновения и может быть менее фототоксичен для живых образцов. Таким образом, микроскопия с двухфотонным возбуждением предпочтительна в тех случаях, когда необходимо глубокое проникновение в живую ткань или интактные образцы животных. Однако, поскольку фотофизика двухфотонного возбуждения отлична от той, которая лежит в основе традиционной флуоресценции, при двухфотонном возбуждении определенных флуорофоров иногда наблюдаются вредные воздействия, ограничивающие применимость этого метода к оптическому сечению тонких образцов.
Принципы двухфотонного возбуждения
Явление двухфотонного возбуждения теоретически давно разработано в квантовой оптике. Впервые оно было рассмотрено в докторской диссертации Марии Гепперт-Майер, а экспериментально подтверждено тридцатью годами позже, вскоре после изобретения лазера. Поэтому, очевидно, что у этого явления есть теоретическая база и экспериментальная история. Двухфотонное возбуждение возникает при одновременном поглощении двух фотонов в единичном квантовом событии. Поскольку энергия фотона обратно пропорциональна длине его волны, два поглощенных фотона должны иметь длину волны в два раза большую требуемой при однофотонном возбуждении. Например, флуорофор, обычно поглощающий ультрафиолет (приблизительная длина волны 350 нанометров), может быть возбужден также и двумя фотонами из ближнего инфракрасного диапазона (длина волны приблизительно 700 нанометров), если они одновременно достигли флуорофора (рисунок 1). Одновременность в нашем случае означает интервал около 10•E(-18) секунды.
Поскольку двухфотонное возбуждение зависит от одновременности поглощения, вызываемое флуоресцентное излучение изменяется пропорционально квадрату силы света возбуждения. Эта квадратичная зависимость между возбуждением и испусканием является причиной многих важных преимуществ микроскопии с двухфотонным возбуждением (подробнее обсуждается ниже). Чтобы обеспечить достаточное число двухфотонных поглощений (когда оба фотона взаимодействуют с флуорофором одновременно), плотность фотонов должна быть примерно в миллион раз больше той, которая требуется для того же числа однофотонных поглощений. Следовательно. для генерации достаточной двухфотонно возбуждаемой флуоресценции, необходимы лазеры чрезвычайно высокой мощности. Эта мощность легко достигается с помощью лазера с синхронизованными модами (импульсного лазера), который на пике импульса способен генерировать необходимое число двухфотонных возбуждений, в то время как его средняя лазерная мощность остается достаточно низкой. В этой ситуации, возбужденное в результате поглощения двух фотонов состояние, в котором происходит последующее испускание, является тем же синглетным состоянием, заселяемым во время проведения обычного эксперимента с регистрацией флуоресценции. Таким образом, флуоресцентное испускание, следующее за двухфотонным возбуждением, в точности то же самое, что и испускание, генерируемое обычным однофотонным возбуждением. На рисунке 1 представлена диаграмма Яблонского, иллюстрирующая поглощение единичного (ультрафиолетового) фотона (рисунок 1(a)) одновременное поглощение двух фотонов из ближнего инфракрасного диапазона (рисунок 1(b)), приводящее к идентичному возбужденному состоянию.
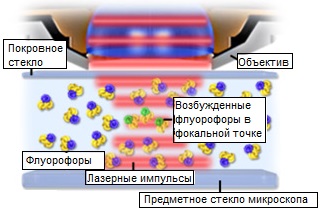
Рис. 2. Возбуждение флуорофоров в многофотонной микроскопии
Другой тесно связанный нелинейный оптический процесс, трехфотонное возбуждение, тоже может оказаться полезным в биологических экспериментах. Трехфотонное возбуждение происходит таким же образом, что и двухфотонный процесс, с той лишь разницей, что для генерации испускания с флуророфором одновременно должны провзаимодействовать три фотона. По квантово-механическим законам флуоресцентного поглощения, плотность фотонов для трехфотонного возбуждения должна лишь в десять раз превышать плотность, необходимую для двухфотонного возбуждения (а не в миллион раз, как при переходе от одного к двум фотонам). Поэтому в некоторых экспериментах трехфотонное возбуждение может считаться привлекательной дополнительной опцией. Например, инфракрасный лазер (с длиной волны около 1050 нанометров) может генерировать трехфотонное возбуждение поглощающего ультрафиолет флуророфора (на 350 нанометрах) и одновременно — двухфотонное возбуждение флуророфора, поглощающего зеленый свет (на 525 нанометрах). К тому же, трехфотонное возбуждение может применяться для расширения области эффективной визуализации до глубокого ультрафиолета (например, можно использовать 720-нанометровый свет для возбуждения флуророфора, поглощающего в ультрафиолете на 240 нанометрах). Это является существенным усилением возможностей традиционного микроскопа, поскольку ультрафиолетовые длины волн, ниже примерно 300 нанометров, весьма проблематичны для обычной микроскопической оптики. Экспериментально продемонстрированы были и нелинейные эффекты более высокого порядка, такие как четырехфотонное поглощение, хотя вероятность их скорого использования в биологических исследованиях весьма мала.
Двухфотонное возбуждение в лазерной сканирующей микроскопии
Значительные преимущества использования двухфотонного возбуждения в лазерной сканирующей микроскопии проистекают из основного физического принципа, по которому поглощение зависит от квадрата интенсивности света возбуждения. На практике двухфотонное возбуждение достигается фокусированием излучения моноимпульсного лазера через оптику микроскопа. При фокусировании лазерного пучка пространственная плотность фотонов возрастает, а значит, возрастает и вероятность одновременного взаимодействия двух из них с одним и тем же флуорофором. Фокальная точка лазера — единственное место на всем оптическом пути, где плотности фотонов достаточно для генерации ощутимого двухфотонного возбуждения. На рисунке 2 с помощью диаграммы проиллюстрирована генерация двухфотонного возбуждения флуророфора в образце в фокальной плоскости микроскопа. В области выше фокальной точки плотность фотонов недостаточно высока для одновременного прохождения двух фотонов через сечение поглощения одного флуорофора. Однако, в фокальной точке фотоны так близко расположены друг к другу, что два из них могут быть одновременно обнаружены в сечении поглощения одного флуророфора.
На практике двухфотонное возбуждение осуществляется не только пространственной концентрацией фотонов (фокусированием оптикой микроскопа), но и концентрацией их во времени (с помощью импульсов лазера с синхронизацией мод). Комбинация этих способов позволяет достигать необходимых для двухфотонного возбуждения концентраций, но скважность импульсов (отношение длительности импульса на период между импульсами) порядка 10•E(-5) ограничивает среднюю мощность 10 милливаттами, что ненамного больше используемой в конфокальной микроскопии. Хотя длительность лазерного импульса считается ультра короткой, обычно между100 фемтосекунд и 1 пикосекундой (от 10•E(-13) до 10•E(-12)), она достаточно велика в сравнении со временем поглощения флуорофора (порядка 10•E(-18) секунд).
Высокая степень локализации двухфотонного возбуждения в фокальной точке освещения обуславливает основное преимущество этого метода перед конфокальной микроскопией. В конфокальной микроскопии, хотя флуоресценция и возбуждается во всем объеме, где освещается образец, точечная диафрагма пропускает лишь сигналы из фокальной плоскости, отсекая остальную информацию. И, напротив, при двухфотонном возбуждении флуоресценция генерируется лишь в фокальной плоскости, и поскольку фоновой флуоресценции нет вообще, точечная диафрагма не требуется. Эта существенная разница в характере возбуждения в конфокальной микроскопии и микроскопии с двухфотонным возбуждением может быть продемонстрирована картиной фотообесцвечивания, получаемой каждым из этих методов. На рисунке 3 представлена картина фотообесцвечивания, получающаяся в x-z направлении от повторных сканирований одной x-y плоскости (плоскости изображения) в окрашенной флюоресцеином формваровой пленки. Лазер конфокальной системы возбуждает флуророфоры выше и ниже фокальной плоскости (выделенной белым прямоугольником на рисунке 3(a)), приводя к наблюдаемому обесцвечиванию в обширных областях. Двухфотонное возбуждение, напротив, возникает только в фокальной плоскости, поэтому обесцвечивание ограничено лишь этим участком (рисунок 3(b)).
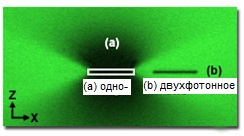
Рис. 3. Картина фотообесцвечивания, получающаяся в x-z направлении от повторных сканирований одной x-y плоскости
Локализация возбуждения в двухфотонной микроскопии создает множество положительных эффектов. Возможно, самым важным из них является то, что трехмерное разрешение, достигаемое в микроскопии с двухфотонным возбуждением, сопоставимо с тем, которое получается при использовании идеального конфокального микроскопа. К тому же, из-за отсутствия поглощения во внефокусных областях образца, большая часть облучающего света проникает сквозь образец к фокальной плоскости. Следствием этого является значительно большая проницаемость образца, которая обычно в два или три раза выше возможной в конфокальной микроскопии. Другим преимуществом двухфотонного возбуждения (показанным на рисунке 3) является минимизация фотообесцвечивания и фотоповреждения — двух наиболее строгих ограничений во флуоресцентной микроскопии живых клеток и тканей. Хотя механизм повреждения клетки при взаимодействии со светом изучен недостаточно, уменьшение фотоповреждения, несомненно, ведет к повышению жизнеспособности изучаемых биологических образцов. Из опыта можно заключить, что красный возбуждающий свет сам по себе не влияет на жизнеспособность клетки, и, возможно, наиболее сильное фотоповреждение связано с двухфотонным поглощением, а, следовательно, ограничено фокальной плоскостью.В микроскопии с двухфотонным возбуждением не используется точечная диафрагма для достижения трехмерного разрешения, что создает большую гибкость геометрических параметров схемы детектирования сигнала. Конфигурации рассканированного и нерассканированного детектирования двухфотонного возбуждения представлены на рисунке 4. В рассканированной конфигурации, испускаемое излучение (изображено синим) возвращается по тому же пути, что и возбуждающий свет, падая на сканирующие зеркала перед тем, как попасть на детектор через конфокальную точечную диафрагму (рисунок 4(а)). В конфокальной микроскопии эта конфигурация применяется для исключения приема внефокусного свечения. Путь нерассканированного пучка предполагает больше альтернативных конфигураций: схема с использованием детектора, размещенного в сопряженной плоскости, дихроичное зеркало находится прямо за объективом (рисунок 4(b) и отражает испускаемый свет через линзу переноса на приемник, расположенный в плоскости, сопряженной с задней апертурой объектива; испускаемое излучение может также приниматься внешним детектором непосредственно из образца, без прохождения света через объектив (рисунок 4(c)); либо испускаемый свет может направляться дихроичным отражателем на камеру прибора с зарядовой связью (ПЗС) в промежуточной плоскости изображения с целью получения широкопольного снимка (рисунок 4(d)). Такие конфигурации применяются для систем ускоренного сбора данных, используемых при двухфотонном возбуждении.
Хотя для двухфотонного возбуждения можно использовать схему рассканированного детектирования, для того, чтобы воспользоваться преимуществами глубокого проникновения, рекомендуется применение и нерассканированной регистрации сигнала (внешнего детектора). Прием сигнала на нерассканированном пути дает возможность собирать больше рассеянных фотонов, не требует большого числа оптических элементов, таких как линзы и зеркала, сокращает длину пути, а вместе с тем и количество пылинок в воздухе на пути флуоресцентного сигнала. Поэтому, использование нерассканированного приема при двухфотонном возбуждении значительно увеличивает эффективность детектирования сигналов, и существенно для максимальной глубины проникновения в живую ткань.
Механизмы глубокого сечения
Как уже обсуждалось выше, наиболее важным преимуществом микроскопии с двухфотонным возбуждением является ее способность получать оптические срезы лучшего качества на больших глубинах толстых образцов, чем это возможно другими методами. Поэтому, важно понимать, за счет чего достигается эта увеличенная глубина проникновения. Эффективное проникновение в толстые образцы обеспечивается сочетанием трех физических механизмов:
- Отсутствие внефокусного поглощения позволяет возбуждающим фотонам достигать заданной в образце глубины.
- Красный и инфракрасный свет, применяемые при двухфотонном возбуждении, подвержены меньшему рассеянию, чем синий свет (более короткие длины волн).
- В двухфотонной микроскопии эффекты от рассеяния света сказываются меньше, чем в конфокальной микроскопии.
Хотя эти три механизма и действуют одновременно, имеет смысл рассмотреть их по отдельности. В двухфотонном микроскопе большая доля возбуждающего излучения достигает фокальной плоскости, поскольку вне области концентрации света отсутствуют условия его поглощения, и внефокусное поглощение исключено. В конфокальном же микроскопе фотоны возбуждения поглощаются любыми флуорофорами, встречающимися на пути света возбуждения. Как следствие, меньшее число фотонов достигает фокальной плоскости, что приводит к ослаблению генерируемого сигнала. Этот эффект усиливается, если флуорофоры распределены по всему объему образца, как показано на снимках на рисунке 5. Представленная на этом рисунке полимерная пленка, окрашенная родамином, сама по себе не является рассеивающей, но содержит высокую концентрацию равномерно распределенных флуорофоров.
Верхняя часть x-z снимков на рисунке 5 является ближайшей к объективу, а интенсивность флуоресценции показана как функция глубины сканирования образца (z расстояние) для каждого x-z снимка. Для однофотонного возбуждения (конфокальная микроскопия, рисунок 5(a)) интенсивность стабильно падает с увеличением глубины проникновения, поскольку поглощение света возбуждения растет по мере достижения более глубоких фокальных плоскостей. Разительный контраст наблюдается при двухфотонном поглощении, которое происходит только в фокальной плоскости, поскольку на всем пути прохождения света возбуждения от объектива до фокальной плоскости, свет не поглощается флуорофорами. Таким образом, вся энергия возбуждения достигает фокальной плоскости, что обеспечивает постоянство флуоресцентного сигнала на всей глубине образца (в нашем примере — полимера). Рисунок 5(b) иллюстрирует существенную разницу между конфокальным и двухфотонным возбуждением, при котором интенсивность почти не меняется с глубиной проникновения.
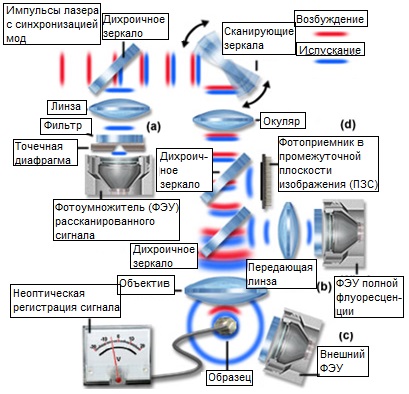
Рис. 4. Конфигурации детектирования сигнала в многофотонной микроскопии
Второй механизм, определяющий эффективность двухфотонного возбуждения при наблюдении толстых образцов, заключается в том, что «более красный» свет возбуждения, применяемый в микроскопии с двухфотонным возбуждением, подвержен меньшему рассеянию в образце, по сравнению с «более синим», применяемым при традиционном возбуждении. Биологические ткани могут считаться неоднородными средами с меняющимися показателями преломления. Свет, проходя через такую среду, многократно рассеивается в различных направлениях. Во флуоресцентной микроскопии возбуждающий свет, падающий на образец, может быть в различной степени рассеян, прежде чем он достигнет фокальной плоскости, а вызываемая им флуоресценция также подвержена рассеянию, проходя обратно сквозь толщу образца к детектору. Оба этих рассеивающих эффекта приводят к ослаблению принимаемого флуоресцентного сигнала.
Из-за неравномерного распределения в биологических образцах веществ с различными свойствами, представляется невозможным точно вычислить или смоделировать характер рассеяния. Тем не менее, рэлеевское рассеяние в первом приближении позволяет минимально оценить долю рассеянного в таких системах света. В нашем примере, количество рассеянного света обратно пропорционально четвертой степени длины волны. Из этого соотношения следует, что 488-нанометровый свет (однофотонный) будет подвержен рассеянию примерно в семь раз большему, чем 800-нанометровый (двухфотонный) свет. Таким образом, эта разница дополнительно способствует увеличению количества света от лазера с двухфотонным возбуждением, достигающего фокальной плоскости, и увеличению глубины проникновения в образец. На практике, наблюдаемое рассеяние от взаимодействия с тканевыми структурами всегда больше рассчитанного по релеевскому закону, но длинные (красные) волны всегда рассеиваются меньше коротких (синих) волн. На стадии приема сигнала во флуоресцентной микроскопии, испускаемая флуоресценция не зависит от способа ее генерации (было ли это одно- или двухфотонное возбуждение), поэтому рассеяние флуоресцентного свечения одинаково влияет на оба метода.
Третий фактор, названный выше, заключается в том, что рассеяние как возбуждающего, так и флуоресцентного света влияет на прием сигнала в двухфотонном методе не так сильно, как в конфокальной микроскопии. Эта разница может быть объяснена с учетом физических процессов формирования изображения в микроскопии с двухфотонным возбуждением. В то время как отсутствие внефокусного поглощения и разница в рассеянии ведут к увеличению доли возбуждающего света, достигающего фокальной плоскости глубоко в неповрежденной ткани, этот третий фактор приводит к увеличению контрастности изображения при двухфотонном возбуждении. Способствующие этому физические аспекты проиллюстрированы на рисунке 6.
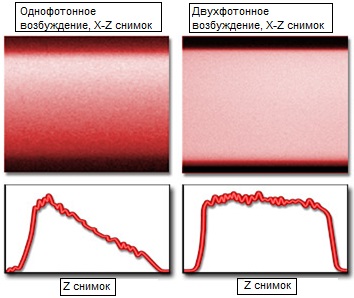
Рис. 5. Однофотонные и двухфотонные профили сканирования
В конфокальном микроскопе (рисунок 6) возбуждающий свет (синий) фокусируется в образце (a), а флуоресценция из фокального пятна (зеленый) улавливается объективом, проходит через точечную диафрагму и достигает фотоприемника (b). Это флуоресцентное свечение и есть цель эксперимента, но часть его может быть рассеяна при его прохождении через образец ©. Диффузно-рассеянная флуоресценция не проходит через точечную диафрагму, поэтому теряется и не регистрируется. Эти потери существенно уменьшают принимаемый флуоресцентный сигнал. При прохождении образца, возбуждающий свет может быть поглощен (d) или рассеян прежде, чем достигнет фокуса (e). При поглощении он может вызвать флуоресценцию. Поскольку это флуоресцентное излучение возникает вне фокусного пятна, оно не попадает в точечную диафрагму, поэтому и не регистрируется. Тем не менее, малая доля внефокусной флуоресценции может быть рассеяна в точечную диафрагму, а затем попасть в детектор. Такая флуоресценция создает фоновую вуаль, которая почти равномерно распределяется по всему снимку, как показано на рисунках 7 и 8. Эта вуаль сокращает динамический диапазон изображения, то есть его контрастность. Подобным же образом, рассеянный возбуждающий свет может порождать флуоресценцию (e), которая тоже может способствовать образованию фоновой вуали (f).
В методе двухфотонного возбуждения (см. также рисунок 6), возбуждающие фотоны (красные линии) могут быть рассеяны (g), как и в конфокальной системе. Тем не менее, вероятность рассеяния двух фотонов в одну и ту же точку образца практически нулевая, и следовательно, фоновая вуаль, ухудшающая конфокальное изображение толстых образцов, не возникает при двухфотонном возбуждении. К тому же, большая доля возбуждающего света достигает фокальной плоскости (h и i) благодаря первым двум факторам, о которых говорилось выше: пониженному внефокусному поглощению и меньшему рассеянию длинноволнового света двухфотонного возбуждения. Важно добавить, что существует значительная вероятность того, что генерируемая флуоресценция (зеленые линии), даже при условии ее рассеяния, будет принята фотоумножителем (j), ввиду отсутствия точечной диафрагмы, которая могла бы перекрыть ход лучей(k). Эта нечувствительность к рассеянию и отсутствие внефокусного поглощения позволяют сохранить контрастность изображения на значительной глубине образца.
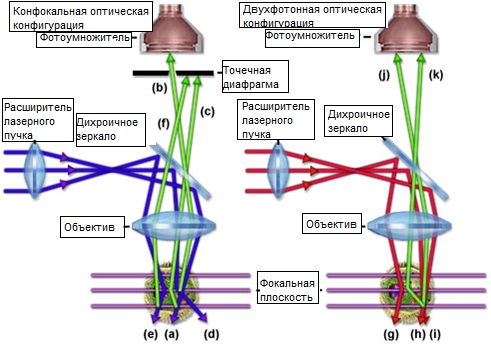
Рис. 6. Оптические конфигурации
По снимкам, представленным на рисунке 7 (хороидное сплетение акулы, окрашенное флюоресцеином), можно судит о качестве визуализации конфокальной и двухфотонной микроскопии. Эти снимки были сделаны на глубине 80 микрометров ниже поверхности образца, что является максимальной глубиной, на которой еще возможна достаточная для этого образца контрастность при использовании конфокальной микроскопии. Хотя уровень сигнала в самых ярких местах сопоставим при визуализации обоими методами, общая контрастность изображения конфокального снимка (рисунок 7(a)) намного ниже из-за фоновой вуали. И напротив, снимок, полученный двухфотонным возбуждением (рисунок 7(b)), имеет превосходную контрастность. Поскольку в толстых биологических образцах рассеяние флуоресценции становится существенным, применение рассканированной регистрации сигнала, даже при «открытой» точечной диафрагме, недостаточно для использования преимуществ двухфотонного возбуждения.
Чтобы использовать весь потенциал этого метода и повысить эффективность регистрации флуоресцентного свечения, необходимо применять схему детектирования нерассканированного сигнала (рисунок 4), в которой флуоресцентный свет не возвращается к фотоприемнику через сканирующую систему, что является обязательным в конфокальном микроскопе. На примере того же (рисунок 7) образца акулы на рисунке 8 для сравнения показаны снимки, полученные методом приема рассканированного («открытая» точечная диафрагма) и нерассканированного сигнала. В каждой конфигурации приема сигнала использовались одни и те же оптические компоненты, включая дихроичное зеркало, пороговый фильтр и фотоумножитель. Сначала образец наблюдался методом приема рассканированного сигнала на глубине (140 микрометров) приблизительно соответствующей максимальной контрастности (рисунок 8(a)). Сохраняя неизменными все настройки, методом приема нерассканированного сигнала был получен снимок, представленный на рисунке 8(b). Очевидно, что этот снимок во многих областях имеет максимальное насыщение (максимально возможная яркость), демонстрируя лучшую собираемость сигнала в нерассканированной конфигурации. Поскольку условия возбуждения были в обоих случаях одинаковыми, восьмикратное увеличение интенсивности сигнала может быть приписано исключительно приему рассеянных флуоресцентных фотонов, обеспеченному конфигурацией приема нерассканированного сигнала. Чтобы получить ненасыщенное изображение во всем градационном интервале (рисунок 8©), напряжение фотоумножителя было уменьшено с 1000 до 750 вольт, имея в виду, что образец мог быть отсканирован даже глубже, при использовании конфигурации приема нерассканированного сигнала. На самом деле, глубина проникновения, на которой еще возможно получить приемлемое изображение этого образца, была ограничена не самой тканью, а рабочим расстоянием объектива.
Разрешение изображения
Разрешение изображения, получаемого при двухфотонном возбуждении, не лучше того, которое достигается хорошо настроенным конфокальным микроскопом. Использование больших длин волн возбуждения (красных или инфракрасных вместо синих или ультрафиолетовых) хотя и является преимуществом двухфотонного возбуждения, в действительности приводит к увеличению порога разрешения. Если биологическую структуру невозможно различить конфокальным микроскопом, то это не удастся и лазерным сканирующим микроскопом с двухфотонным возбуждением. Это хорошо известно опытным в применении этих методик микроскопистам, но начинающие исследователи в биомедицине часто полагают, что преимущества двухфотонного возбуждения включают и более высокое разрешение.
Визуализация толстых образцов
Как говорилось выше, двухфотонное возбуждение более эффективно при визуализации толстых образцов благодаря сочетанию трех факторов: отсутствие внефокусного поглощения приводит к тому, что большая доля возбуждающего света достигает заданной области образца; красный возбуждающий свет рассеивается меньше; рассеяние флуоресценции менее разрушительно для двухфотонной, чем для конфокальной микроскопии. При использовании оптики с большим рабочим расстоянием и конфигурации приема нерассканированного сигнала, глубина проникновения и качество изображения часто ограничены возможностью эффективного окрашивания образца. Введение флуоресцентных красителей в ткани тем сложнее, чем глубже исследуемая область. Эксперименты, использующие преимущества экспрессии зеленого флуоресцентного белка (GFP) в трансгенных животных, похоже, способны повысить эффективность визуализации двухфотонным возбуждением in vivo. Генетически измененные животные открывают широкую перспективу в развитии техники флуоресцентного окрашивания отдельных органов и белков в живых тканях для их последующего наблюдения методом двухфотонного возбуждения. Некоторые характеристики тканей могут накладывать дополнительные ограничения на глубину проникновения при визуализации толстых образцов. Это особенно касается сильно пигментированных тканей, таких как печень, или сильно рассеивающих тканей, таких как кожа.
Визуализация тонких образцов
В общем, при визуализации тонких образцов метод двухфотонного возбуждения не обязательно имеет преимущества перед обычной конфокальной микроскопией. Причина этого в несколько большем фотообесцвечивании, которое может иметь место в фокальной плоскости (хотя суммарное фотообесцвечивание толстых образцов намного меньше в сравнении с традиционными методиками, как показано на рисунке 3). Тем не менее, существуют приложения, для которых применение двухфотонного возбуждения целесообразней даже для тонких образцов; примером может служить визуализация возбуждаемых ультрафиолетом флуорофоров, таких как NADH (обсуждается ниже). В таких экспериментах вред, наносимый ультрафиолетом, более губителен, чем вызываемое двухфотонным возбуждением фотообесцвечивание. Оценивая потенциальные преимущества двухфотонного возбуждения, стоит сначала провести наблюдения на конфокальном микроскопе. Зная ограничения, накладываемые на изображение, конфокальным методом, легче определить целесообразность применения в данном эксперименте метода двухфотонного возбуждения.
Спектр поглощения
В общем, спектры двухфотонного поглощения имеют мало сходства с соответствующими однофотонными спектрами. Накопленный к настоящему времени опыт указывает на то, что флуророфоры достаточно хорошо реагируют на двухфотонное возбуждение на длине волны в два раза большей той, на которой достигается пик поглощения флуророфора при однофотонном возбуждении. По физико-химическим причинам, лежащим вне рамок нашего обсуждения, флуорофоры с несимметричной химической структурой более склонны к этому взаимодействию, чем симметричные. Например, флуоресцентные белки (CFP, GFP, YFP и другие) характеризуются несимметричными флуорофорами и поглощают строго на длине волны, в два раза большей той, которая требуется при однофотонном возбуждении. Но для использования всех возможностей микроскопии с двухфотонным возбуждением, тем не менее, необходимо измерять спектры поглощения флуорофоров. Технически это значительно трудней, чем измерение обычного спектра однофотонного поглощения, и информации на этот счет совершенно недостаточно. Но поскольку применение этой методики растет, спектры двухфотонного поглощения, вероятно, станут более доступными для широких кругов.
Локализованная фотохимия
Еще одним свойством двухфотонного возбуждения является его способность инициировать фотохимические реакции в фокальной области образца. Множество экспериментально ценных химических процессов включают реакции, инициируемые ультрафиолетовым облучением, которое может быть заменено двухфотонным возбуждением. Реакции одной категории, (высвобождение красителя, заключающееся в фотохимическом преобразовании нефлуоресцентной молекулы во флуоресцентную) могут быть инициированы в отдельных клетках ткани с помощью двухфотонного возбуждения. Аналогично, биологические стимуляторы и супрессивные средства могут быть высвобождены тем же процессом возбуждения. Возможные разнообразные методы высвобождения двухфотонным возбуждением еще предстоит развить. Ограничения на этом пути проистекают из кинетики фотореакций, длительность которых лежит в диапазоне от миллисекунд до секунд. Например, за время между облучением и приобретением флуоресцентных свойств, вещество-мишень может диффундировать в образце на несколько микрометров. Несмотря на эту трудность, эта техника, похоже, приобретает все большую значимость в ряде интересных биологических приложений, некоторые из которых обсуждаются в следующих разделах.
Лазерные источники
Требования к инструментарию в микроскопии с двухфотонным возбуждением почти идентичны предъявляемым в конфокальной микроскопии, за исключением значительно отличающихся друг от друга лазерных источников света. В современных микроскопах с двухфотонным возбуждением применяются два типа ультрабыстрых лазеров с синхронизацией мод: Ti: сапфировый и Nd:YLF лазеры. Хотя это оборудование может работать от обычной электрической розетки и не требует водяного охлаждения, оно значительно дороже небольших лазеров с воздушным охлаждением, применяемых в конфокальной микроскопии. Из-за перестраиваемости длины волны (от 700 до 1100 нанометров) Ti: сапфировый лазер обладает большей гибкостью применения по сравнению с одноволновым Nd:YLF лазером (1047 нанометров), а современные промышленные модели Ti: сапфировых лазеров перекрывают диапазон от 720 до 900 нанометров благодаря легко подключаемому компьютерному управлению. Тенденция к большей простоте использования и настройки лазерных осветителей, похоже, будет сохраняться и в обозримом будущем.
Мощность лазеров
При облучении образцов, содержащих флуророфоры, светом возбуждения, существует естественное ограничение на мощность лазеров. С увеличением мощности лазерного излучения, интенсивность флуоресценции растет до точки насыщения флуорофоров. Условие насыщения возникает, когда мощности лазера достаточно для перевода значительной доли флуоресцентных молекул из основного в возбужденное состояние (для однофотонного возбуждения она составляет примерно 1 милливатт, а для двухфотонного возбуждения — 50 милливатт). При больших уровнях мощности избыточные фотоны просто неспособны возбуждать флуоресцентные молекулы. Любое облучение за точкой насыщения приводит только к фотоповреждению и фотообесцвечиванию. Поэтому, каждую экспериментальную установку необходимо оценивать с точки зрения повреждений, вызываемых сканированием луча; кроме того, также важно осознавать, что обычные тесты на жизнеспособность клетки (такие как активность эстеразы или освобождение красителя) не всегда точно отражают фотоповреждение клетки. Во многих экспериментах более строгие функциональные пробы могут оказаться более информативными. Например, в одном недавно опубликованном исследовании, жизнеспособность эмбриона хомяка была подтверждена его продолжающимся развитием, а в другом, жизнеспособность панкреатических островков — поддержанием нормальной NAD(P)H реакции.
Примеры применения микроскопии с двухфотонным возбуждением
В недавно опубликованных результатах целого ряда экспериментов приведены общие примеры, когда двухфотонное возбуждение имеет преимущество над конфокальным методом. Не обсуждая эти эксперименты в подробностях, можно утверждать, что главное место в них отводится преимуществам двухфотонного возбуждения, связанным с меньшей фототоксичностью, увеличенной глубиной наблюдения тканей и возможностью инициировать локализованную фотохимию.
Микроскопия с двухфотонным возбуждением, в общем, менее токсична по сравнению с конфокальной микроскопией, как было показано в недавнем исследовании, где применялась съемка развития эмбриона хомяка в заданный временной интервал. В этом примере развитие эмбриона можно было непрерывно наблюдать более 10 часов с помощью двухфотонного возбуждения прижизненного митохондриального красителя. Для сравнения, при наблюдении конфокальным способом нормальное развитие эмбриона прекращалось уже через несколько минут после облучения конфокальным лазером. Исследователи заключили, что необычайно возросшая жизнеспособность эмбриона стала возможной благодаря большей длине волны (1047 нанометров) лазера с двухфотонным возбуждением. Эти же исследователи использовали микроскопию с двухфотонным возбуждением для оценки влияния на развитие эмбриона хомяка минерального фосфата. В этом эксперименте живые эмбрионы хомяка выращивались в различных количествах минерального фосфата, а их митохондриальное распределение наблюдалось в возрасте 6 часов с помощью микроскопии с двухфотонным возбуждением. В процессе наблюдения дальнейшего развития эмбриона в возрасте 27 и 51 часа был выполнен морфологический анализ. Из этого исследования были получены ясные доказательства того, что двухфотонное освещение не нарушает развития эмбрионов хомяка; в то же время как при проведении параллельного конфокального наблюдения, они были повреждены.

Рис. 7. Качество изображения в конфокальной и многофотонной микроскопии
Два опубликованных исследования были посвящены нетоксичному характеру двухфотонного возбуждения при визуализации in vivo человеческой кожи. Одно исследование включало детальную спектроскопию автофлуоресцентных сигналов, собираемых на различных глубинах (от 0 до 50 и от 100 до 150 микрометров) с использованием облучающих волн на длинах от 730 до 960 нанометров. Наблюдения велись в сочетании с отражательной конфокальной микроскопией. Комбинацией двух методов удалось без нанесения вреда образцу получить подробные автофлуоресцентные снимки и снимки в отраженном свете слоев кожи одного и того же участка.
Двухфотонное возбуждение позволяет избежать фототоксических эффектов ультрафиолетового облучения для образцов, возбуждаемых в этом диапазоне. Это свойство особенно важно при визуализации естественно возникающих восстановленных пиридиннуклеотидов (NAD(P)H) как индикаторов клеточного дыхания. Поскольку NAD(P)H имеет малое сечение поглощения и низкий квантовый выход, а поглощает в ультрафиолетовой области спектра, его трудно возбудить и измерить, не нанеся, к тому же значительного фотоповреждения. Визуализация NAD(P)H применялась при изучении патофизиологии культивируемых частично дифференцированных L6 клеток мышечной трубочки. Автофлуоресцентное свечение на снимках клеточных NAD(P)H первоначально отражало NADH в митохондриях в виде пятнистых участков на фоне рассеянного цитоплазматического сигнала. В дифференцированных клетках флуоресценция наблюдалась в виде колонн митохондрий локализованных между полосок мышечного волокна, а увеличение флуоресценции соответствовало увеличению концентрации глюкозы. В этом исследовании была продемонстрирована однородность метаболизма глюкозы и возможность исследования кинетики использования глюкозы в реальном времени либо в одной клетке, либо по усредненному значению по нескольким клеткам.
Дополнительные исследования, опубликованные в научной литературе, были посвящены количественной двухфотонной визуализации NAD(P)H и сосредоточены на отдельных бета-клетках в панкреатическом островке, который представляет собой квази-сферический микроорган, состоящий примерно из 1000 клеток. Пространственное разрешение при визуализации двухфотонным методом всех нуклеотидов позволяет различать цитоплазматические и митохондриальные сигналы NAD(P)H. На рисунке 9 представлен типичный снимок автофлуоресценции NAD(P)H бета-клеток в интактном островке, сформированный сигналами, как из цитоплазмы, так и из митохондрий (последние светлей и несколько пятнистей). Видны контуры отдельных клеток, а также их ядра, темные для клеток обоих типов. Благодаря разделению цитоплазматического и митохондриального сигналов из бета-клеток панкреатического островка, стало возможным подробное изучение обмена глюкозы и пирувата.
В современных моделях глюкозо-стимулируемой секреции инсулина (ГССИ) предполагается, что метаболиты, расположенные далее по пути сигнальной трансдукции, должны стимулировать аналогичный каскад сигнальный событий и вызывать секрецию инсулина; хотя, сам по себе, пируват и не индуцирует секрецию инсулина, но он усиливает ГССИ. В обсуждаемом исследовании двухфотонное возбуждение использовалось для визуализации NAD(P)H и разделения цитоплазматических и митохондриальных сигналов, чтобы продемонстрировать, что бета-клетки усваивают пируват, хотя и кратковременно. Такая кратковременная митохондриальная реакция предполагает две различные модели, изучаемые в настоящее время: на поздней стадии метаболизма пирувата подавляется либо перенос пирувата в митохондрии, либо трикарбоновый цикл. С помощью метода двухфотонного возбуждения живые панкреатические островки неоднократно сканировались для получения данных в интервалах дискретизации, что невозможно биохимическими методами. Неоднократная визуализация такого рода была бы просто невозможна с помощью конфокальной микроскопии из-за ограничений, накладываемых фотообесцвечиванием фотоповреждением, вызываемым ультрафиолетом.
Поскольку в микроскопии с двухфотонным возбуждением применяются лазеры с синхронизованными модами (импульсные), она может легко использоваться в комбинации с визуализацией изображений в течение времени высвечивания. Снимки, полученные на основе наносекундного затухания флуоресцентного свечения, дают информацию, независимую от концентрации флуорофоров. Одним из возможных приложений визуализации в течение времени высвечивания является получению точного значения эффективности резонансного переноса энергии флуоресценции (FRET) между двумя красителями-зондами. В недавнем исследовании визуализация в течение времени высвечивания была реализована на двухфотонном микроскопе для количественного определения концентрации NAD(P)H в различных внутриклеточных компартментах. Свободные уровни NADH в ядрах регулируют корепрессор CtBP, участвующий в клеточном цикле регуляции и трансформации транскрипционных путей. Одновременное применение к исследованию NAD(P)H микроскопии с двухфотонным возбуждением и визуализации в течение времени высвечивания показало, что уровни свободных NADH соответствуют половине максимальной концентрации CtBP.
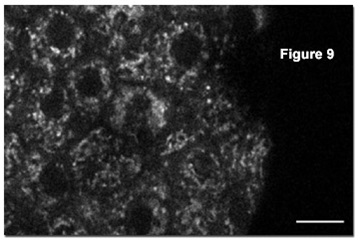
Рис. 8. Детектирование рассканированного и нерассканированного сигнала
Метод двухфотонного возбуждения может быть объединен со многими другими разработанными биофизическими методиками, включая флуоресцентную корреляционную спектроскопию (FCS) и восстановление флуоресценции после фотообесцвечивания (FRAP). В каждой из этих методик обычно применяется стационарные однофотонные (непрерывного излучения) лазеры. Методом ФКС определяются диффузионные характеристики и число задействованных флуоресцентных зондов в фокальном объеме непрерывного освещающего пучка. Она была успешно применена в исследованиях молекулярного взаимодействия и диффузионных свойств. Контролирование фотообесцвечивания флуоресценции в области лазерного фокуса с последующим восстановлением флуоресценции (FRAP) применялось для изучения макроскопической диффузии флуоресцентных молекул. Как ФКС, так и FRAP широко применялись для исследования диффузионных характеристик флуоресцентных зондов на мембранах культивируемых клеток. На сегодняшний день сложность этих методик ограничивает их применение в системах in vitro и в экспериментах с клеточными культурами. Когда в любой из этих методик требуется получить количественные данные, лучше воспользоваться преимуществами микроскопии с двухфотонным возбуждением, в которой точно определяется область возбуждения. К тому же ФКС и FRAP могут оказаться весьма ценными при изучении биомолекулярной динамики в толстых живых тканях, если их применять с двухфотонным, а не однофотонным возбуждением.
Глубокое проникновение, доступное при двухфотонном возбуждении, позволяет проведение визуализации in vivo, хотя при наблюдении живых животных и необходимо преодолеть ряд трудностей. Наблюдение флуоресценции in vivo при двухфотонном возбуждении может осуществляться через хирургические вскрытия кожи живого животного или через помещенные на животное покровные «окна». Значительную дополнительную трудность при работе с живыми животными представляет флуоресцентное окрашивание образца. В одном опубликованном исследовании сообщалось об использовании Ca2+ индикатора для специфического окрашивания нейронов живой мыши, позволяющем следить за функционированием нервной системы с помощью двухфотонного возбуждения. Экспрессия зеленого флуоресцентного белка (GFP) в трансгенных животных для флуоресцентного окрашивания отдельных органов или белков должна обязательно привести к дополнительному применению двухфотонного возбуждения для визуализации in vivo. Поскольку при наблюдении живых образцов существует вероятность того, что они могут двигаться, большинство исследований проводятся под наркозом, а скорость визуализации увеличивается, чтобы уменьшить влияние этого движения. Не исключено, что будущие технологические достижения, такие как миниатюризация двухфотонных микроскопов для их непосредственного прикрепления к живым образцам, позволит наблюдать свободно двигающихся животных.
Некоторые исследователи применили ввод большого количества кальциевого индикатора для наблюдения его с помощью микроскопии с двухфотонным возбуждением, чтобы составить карту микросхем нейронов в мозговом срезе мыши. Их метод заключался в том, чтобы запустить сигнальные нейроны, а затем фиксировать кальциевые сигналы, инициированные при взаимодействии с так называемыми «ведомыми» нейронами. Было установлено, что неокортекс состоит из множества точно организованных микросхем. Ведомые принадлежали к нескольким анатомическим классам, их положения были определены и могли быть предсказаны для различных животных.
Потенциально очень мощным приложением микроскопии с двухфотонным возбуждением является трехмерно-разрешимое фотовысвобождение связанных соединений, называемое высвобождением. Количественно заданное высвобождение кальция двухфотонным возбуждением, например, является основой многих методик. Как говорилось выше, фотохимическое высвобождение происходит достаточно медленно (от миллисекунд до секунд), что позволяет соединению-мишени за время между возбуждением и активацией диффундировать в образце на несколько микрометров. В некоторых приложениях, таких как «маркировка» клетки высвобождением нестойких флуоресцентных молекул мембраны, диффузия не является проблемой. Одной группе исследователей удалось применить фотовысвобождение двухфотонным возбуждением в сочетании с конфокальной микроскопией для того, чтобы проследить последовательность клеточных поколений в развитии эмбриона морского ежа.
Молекулы с быстрым высвобождением с успехом были использованы другими исследователями в работах по высвобождению стимуляторов, где они применили двухфотонное возбуждение для составления карты нейронных рецепторов. С учетом преимуществ трехмерного характера двухфотонного возбуждения, фотохимическое высвобождение было использовано также и для определения местоположения высвобожденных стимуляторов в визуализируемой среде. При высвобождении стимулятора около мембраны клетки он стимулировал рецепторы в непосредственной близости от себя, и это регистрировалось фиксацией потенциала клетки. При визуализации этого типа изображение составлялось не по испущенным фотонам, а скорее по измеряемой реакции на возбуждение. В качестве успешного примера можно привести составление карты глутаматных рецепторов регистрацией сигналов от высвобожденного MNI-глутамата в сочетании с фиксацией в конфигурации «whole-cell». Образцами выступали тонкие срезы культурных гиппокампальных нейронов и гиппокампальных CA1 пирамидальных нейронов. Исследователям в этой работе удалось получить превосходные боковые (0,6 мм) и продольные (1,4 мм) значения диаметров полной ширины на полувысоте максимума (ПШПВ), свидетельствующие о быстром протекании реакции высвобождения. В последствии им также удалось установить, что глутаматные рецепторы типа AMPA (амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты) присутствуют в больших количествах в грибовидных шипиках, и что распределение этих рецепторов в значительной степени коррелирует с геометрией шипиков.
Заключение
Микроскопия с двухфотонным возбуждением оказывается чрезвычайно полезной при динамической визуализации живых клеток в толстых образцах, особенно в интактных тканях. Благодаря этому методу стало возможным проведение многих экспериментов, невыполнимых традиционными методами, или в которых этими методами не удавалось получить необходимую информацию. Благодаря способности лазера с синхронизованными модами (импульсного лазера) создавать достаточную плотность фотонов в фокальной точке, двухфотонное возбуждение происходит лишь в фокальной плоскости. Преимущество локализованного возбуждения состоит в том, что испускание света ограничено узкой фокальной областью, что избавляет от необходимости использования точечной диафрагмы. Более того, ограниченная область возбуждения уменьшает фототоксичность исследуемых тканей, поскольку фотоповреждение в значительной степени ограничено фокальным участком.
Хотя микроскопия с двухфотонным возбуждением не дает более высокого разрешения изображения, чем конфокальная микроскопия, она позволяет проникать в толстые образцы на большую глубину. Большая глубина проникновения возможна частично из-за геометрии «открытой» точечной диафрагмы в двухфотонном микроскопе, а также благодаря отсутствию внефокусного поглощения возбуждающего света и его меньшему рассеянию (из-за большей длины волны). Чтобы в полной мере воспользоваться возможностью глубокого проникновения, необходимо использовать конфигурацию детектирования нерассканированного сигнала, которая позволяет значительно повысить эффективность приема рассеянных флуоресцентных фотонов. Преимущества двухфотонного возбуждения уже не требуют подтверждений и позволяют проводить эксперименты, невыполнимые с помощью конфокальной микроскопии. Этот метод становится все более популярным благодаря технологическим достижениям и удешевлению оборудования, поэтому число интересных экспериментальных открытий, полученных с его помощью, скорее всего, будет расти.

Ноя 09 2018